Петербуржец пять лет участвует в клинических испытаниях лекарств. он рассказывает, сколько ему платят и как это влияет на здоровье
Содержание:
- Рискнуть здоровьем ради больших денег
- Фаза II. Проверка действия на заданную цель: конкретный вид заболевания
- Присмотр за детьми, животными или квартирой
- «Люди думают, что мы лабораторные мыши»
- «Тебе дают страховку на 2 миллиона на случай смерти»
- Для участия в медицинском исследовании приглашаются Добровольцы -мужчины от 18 до 50 лет
- Фаза III. Подтверждающие исследования
- Текущие эксперименты
- Продолжительность клинических исследований онкологических заболеваний
- Как осуществляется процедура донации?
- Этапы проведения клинического исследования:
- Как проходят клинические исследования
- Какие бывают виды клинических исследований?
- Порядок действий при очной консультации:
- Весомые аргументы
- Стать подопытным
- Медицинские Эксперименты За Деньги Москва
- Заключение
Рискнуть здоровьем ради больших денег
На втором этапе действие препаратов исследуется уже на ограниченном числе добровольцев, у которых имеется определенное заболевание, чтобы понять, способно ли лекарство делать то, для чего предназначено. В третьей стадии участвуют уже несколько тысяч пациентов: таким образом изучается эффективность лекарственного средства и его оптимальная дозировка. Если результаты положительные, препарат регистрируется и выпускается на рынок. Наконец, на завершающей, четвертой стадии проходит ознакомление с новым препаратом врачей и пациентов. Вся информация собирается в общем банке данных для изучения долгосрочных эффектов и выработки дополнительных показаний к его использованию.
Первые испытания препаратов проводят на животных. И только после того, как их результаты одобрит уполномоченная комиссия, начинаются исследования с участием людей. «Они состоят из четырех этапов. Первый проводится на здоровых добровольцах за денежное вознаграждение. Стоит заметить, что среди испытуемых немало студентов, для которых это неплохая подработка. На этой стадии выявляется, как лекарство действует на организм, какова его фармакологическая активность», — объясняет Штефен Шефер, который уже считает себя профессионалом в этой сфере.
Фаза II. Проверка действия на заданную цель: конкретный вид заболевания
Участники: 100 — 500 пациентов.
Длительность: от нескольких месяцев до 2 лет.
Цель: проверка эффективности при определенных показаниях
Необходимо изучить, насколько новый препарат эффективнее по сравнению с плацебо или уже существующим лечением. Плюс, большее количество участников позволяет обнаружить более редкие побочные эффекты, которые не выявлены в фазе I.
Для участия в этой фазе КИ пациенты отбираются по гораздо большему количеству критериев, чем в первую фазу. Например, не просто «рак молочной железы», а «рак молочной железы, стадия T2N1M0, HER2-положительный подтип».
Обычно на этой стадии исследования проводятся как двойные слепые рандомизированные плацебо-контролируемые.
Двойное ослепление: ни врач, ни пациент не знают, кто получает активное вещество, а кто — плацебо или оптимальное существующее на данный момент лечение.
Рандомизация подразумевает, что пациенты делятся на группы случайным образом — с помощью генератора случайных чисел. Повлиять на этот процесс не может ни врач, ни участник КИ.
Плацебо-контроль означает, что участники одной группы будут получать плацебо в таких же условиях, что и участники другой группы, которым дают активное вещество.
Всем — одинаковые на вид, вкус и запах лекарства.
Вся эта «конспирология» нужна, чтобы исключить умышленное или неосознанное искажение данных эксперимента участниками или исследователями.
Так, в первой фазе, где нет таких жестких требований, бывают ошеломительные результаты. Это «грязная» статистика, в фазе II она очищается от лишнего и результаты становятся правдоподобными.
Согласно данным FDA, лишь 33% препаратов, дошедших до фазы II, успешно проходят КИ и переходят в следующую фазу.
Присмотр за детьми, животными или квартирой
А что, думаете нет людей, которые этим промышляют. Как раз наоборот, те, кому не удалось получить высшее образование, чтобы потом целыми сутками просиживать штаны в офисе, пытаются выжить в этом агрессивном и опасном мире, хватаясь за любую возможность заработать.
Помимо этого у обычных людей не всегда есть время проследить за своими отпрысками, собачками и кошечками, даже за собственной квартирой не всегда получается уследить.
Вот тут-то вы и приходите на помощь. Предлагаете свои услуги, просите не слишком кругленькую сумму, но и сами оцениваете тяжесть работы и приступаете к ней.
Разумеется, если вы парень и вам всего 19, то никто вас к ребёнку не подпустит, а вот погулять с лабрадором запросто предложат, поэтому тут главное правильно выбрать своего клиента и выполнять всё чётко по выданным инструкциям.
Как показывает, опыт заработанных денег может легко хватить, чтобы сделать из этого источник своего основного дохода, разумеется, при определённом рвении к работе и необходимом старании.
Помимо этого вы можете ознакомиться с тем, как можно заработать на фотографировании. Опять-таки высшего образования такой способ заработка от вас не требуется, главное, чтобы было свободное время.
«Люди думают, что мы лабораторные мыши»
Илья, 29 лет, доброволец, Москва:
Пять лет назад я переехал в Москву из Смоленской области и долго не мог найти постоянную работу. Перебивался случайными заработками. В Москве полно подработок и легких денег. Как-то наткнулся на сайт с разного рода оплачиваемыми опросами. По типу: пришел в офис, тебе дали три стакана сока выпить, и ты заполняешь анкету, оцениваешь напиток. Все это занимало минут 30 и стоило от 500 рублей.
В один прекрасный день я наткнулся на оплачиваемые клинические исследования на биоэквивалентность различных препаратов: на людях тестировали две разные таблетки и смотрели, как быстро они всасываются в кровь. Одна таблетка — известный препарат, который уже есть на российском рынке, вторая таблетка только готовится выйти на рынок. За исследования платили лучше, чем за опросы, но и времени они занимали гораздо больше. Я участвовал в пяти или шести различных исследованиях, получал от 12 000 до 22 000 рублей.
В первый раз было страшно. Но на каждом исследовании тебе дают договор, где прописаны все условия и возможные побочки. Я ходил только по безопасным препаратам типа таблеток от холестерина, таблеток для курящих, даже «Виагра» была. Вреда никакого не ощутил. От одной таблетки какой вред — это же не курс.
Исследования проходили в разных больницах под пристальным вниманием врачей. Больничный режим соблюдался строго
Нас не отпускали домой или в магазин. Обычно приходишь вечером, сдаешь кровь и мочу. Утром, в зависимости от исследуемого препарата, тебя либо кормят завтраком, либо оставляют голодным до обеда — это тяжело. Часов в семь давали первую таблетку, потом вставляли катетер в вену, через 15 минут начинался забор крови. Надо было идти в кабинет, и через катетер из тебя сливали чуть крови. Такие походы были частыми: через 5, 10, 25, 40 минут после установки катетера и т. д. Последний забор крови был перед сном. Так себе удовольствие, когда в тебе весь день пластиковая трубка. Пару раз девушкам становилось плохо от забора крови, их снимали с исследования. Больше никаких страшных симптомов от принимаемых препаратов не было. Иногда от нечего делать разговаривали с медперсоналом. Они по молодости тоже участвовали в подобных исследованиях. На ночь катетер снимают, а на следующее утро происходит обычно последний забор крови, и тебя отпускают домой. Либо ты до вечера находишься в палате и еще пару раз сдаешь кровь, а вечером тебя отпускают. Существуют еще так называемые «хвосты»: надо еще несколько раз в течение недели прийти и сдать кровь. Это была первая фаза исследования. В ней тебе давали либо оригинал таблетки, либо исследуемый аналог. На втором этапе давали уже вторую таблетку, и все повторялось. Таблеток всегда было две, не больше. Обычно дней через десять после окончания исследования платили деньги, наличными или на карту, сколько прописано в договоре. Меня ни разу не обманули.
Добровольцы участвовали в исследованиях не от хорошей жизни. Это были относительно легкие деньги, не надо работать головой или физически. Просто лежишь в больнице, тебя кормят и периодически берут кровь. Выбор очевиден: работать грузчиком полмесяца-месяц или полежать в больнице два-три дня, где тебя еще и покормят, и получить те же деньги.
Родные о таком способе заработка не знали и не знают до сих пор. Люди советской закалки подозрительно к такому относятся, думают, что на нас ставят опыты, как на лабораторных мышах.
По правилам, участвовать в исследованиях можно раз в три месяца. Я этим не злоупотреблял. Потом устроился на нормальную работу и это дело забросил.
«Тебе дают страховку на 2 миллиона на случай смерти»
Елена, 29 лет, Санкт-Петербург:
С 12 лет я страдаю от капельного псориаза. За это время перепробовала много разных лекарств. Болезнь выражена сильно, кожа поражена на всем теле. О бесплатной программе клинического исследования лекарства от псориаза я узнала от подруги: ей предложили поучаствовать во время сдачи анализов на санитарную книжку. Она побоялась, а я поехала к врачу, который мне все подробно объяснил. Я подумала: а почему бы и нет? Тем более что платить не надо. Это была моя первая программа.
Конечно, было страшно, особенно когда прочла список возможных побочек и получила страховку на 2 миллиона на случай смерти. К счастью, все обошлось.
Исследования проходили в течение полугода: каждые две недели мне внутримышечно вводили лекарство, один раз в месяц я сдавала анализы. Побочек я не заметила никаких. Лекарство мне очень быстро помогло: за два месяца тело очистилось почти на 100%. Но потом, видимо, мой иммунитет нашел ключ к этому препарату, и псориаз вернулся. Сейчас все так же, как было до исследования. Но все это индивидуально. В моей группе были добровольцы, которым лекарство помогло.
Для участия в медицинском исследовании приглашаются Добровольцы -мужчины от 18 до 50 лет
По окончанию исследования приблизительно 20 июня Вы получите вознаграждение за участие в исследовании это 20000 тыс руб. Вы подписываете договор на участие в исследовании, Вас страхуют + в больнице будет бесплатное питание, исследования продлится по 20 июня, вознаграждение получаете 20 июня 20 тыс руб. Если Вы готовы участвовать, 14 мая к 9-45, Вам нужно будет приехать на сдачу анализов в мед центр, он расположен территориально метро новогиреево, от метро нужно добраться общественным транспортом. После сдачи анализов, Вам еще раз подробно расскажут о процедуре исследования и с воскресенья с 18-00 Вам нужно будет начать участвовать в исследовании. НА ИССЛЕДОВАНИЕ ОБЯЗАТЕЛЬНО НУЖНО ПРИНЕСТИ ПАСПОРТ.
Вам будет предложено тестировать данные препараты: Ауранекс, таблетки, покрытые пленочной оболочкой, 10 мг (производства Фармацевтический завод «Польфарма» АО, Польша) и Акатинол Мемантин, таблетки, покрытые пленочной оболочкой, 10 мг (производства Мерц Фарма ГмбХ и Ко. КГаА, Германия)Препарат на Российском рынке более 15 лет, пошел все клинические и до клинические исследования. Цель тестирования препарата: Его Оценка биоэквивалентности.
Фаза III. Подтверждающие исследования
Количество участников: 300 — 3 000 и более.
Продолжительность: от года до нескольких лет.
Цель: подтверждение эффективности и безопасности исследуемого вещества на больших выборках.
Это самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Цель таких исследований — подтвердить эффективность и безопасность исследуемого вещества при применении большим количеством пациентов.
По результатам этой фазы производители препарата получают разрешение для вывода его на рынок.
В фазе III могут принимать участие тысячи пациентов из разных стран. Все должно быть спланировано до мелочей, чтобы во всех местах проведения исследования его дизайн и значимые условия были абсолютно одинаковыми.
Дизайн исследования настолько узкий, что в него может попасть не только умирающий, но и пациент с прогнозом на стойкую ремиссию. Препарат должен быть настолько безопасным, чтобы его можно было давать практически здоровому человеку — и качество жизни не снижалось.
Перед началом фазы III проводится множество консилиумов и обсуждений между исследователями и сторонними экспертами: очень важно продумать дизайн экспериментов так, чтобы не упустить важное и получить все нужные данные. В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы
В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы.
Анализируется соотношение преимуществ и рисков. По результатам контролирующий орган принимает решение о том, можно ли выводить препарат на рынок. Для этого нужно, чтобы соблюдались условия:
- препарат более эффективен, чем ранее известные аналоги,
- дает меньше побочных эффектов/лучше переносится,
- эффективен, когда не работают ранее известные препараты,
- более выгоден экономически,
- проще в применении.
Процесс рассмотрения заявки надзорным органом занимает 12–18 месяцев.
По данным FDA, третья фаза клинических исследований заканчивается положительным результатом лишь в 25–30% случаев от всех, что были на старте третьей фазы.
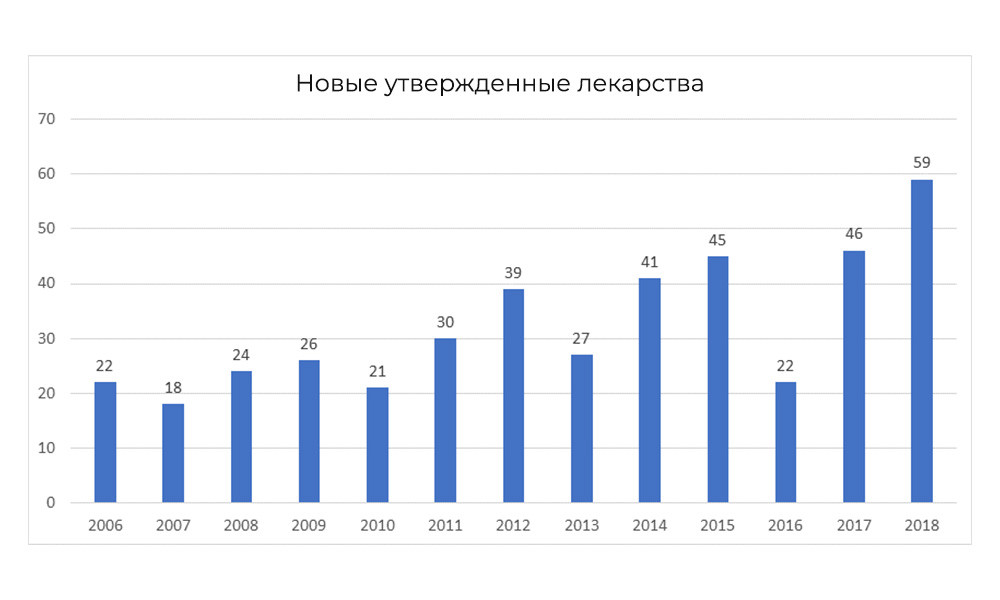
Тем не менее, в 2018 FDA побила собственный рекорд по числу одобренных препаратов
Текущие эксперименты
В исследованиях Центра мы проводим самые разные эксперименты: от простых поведенческих до требующих применения сложной техники. В экспериментах мы используем такие методы, как отслеживание движений глаз на видеоокулографе, функциональная томография мозга, магнитная и электрическая стимуляция коры головного мозга, электроэнцефалография. Приглашаем принять участие в исследованиях детей, людей пожилого возраста и всех желающих. Если вы хотите внести вклад в науку, узнать, как выглядит ваш мозг, стать контрольным испытуемым в новом диагностическом тесте, или опробовать на себе интересный научный метод — добро пожаловать!
Если ваш родной язык — русский, и вы не переносили черепно-мозговую травму, неврологическое или психиатрическое заболевание, заполните анкету, ч тобы принять участие в экспериментах лаборатории. Мы обязательно свяжемся с вами во время проведения следующего исследования.
Продолжительность клинических исследований онкологических заболеваний
Длительность клинических исследований может варьироваться в широком диапазоне. Для некоторых достаточно считанных недель, другие длятся годами. Зависит продолжительность клинических исследований онкологии от целей и сложности. Продолжительность всегда оговаривается протоколом исследования.
Если у Вас или у Ваших близких поставлен данный диагноз, приглашаем Вас пройти лечение в рамах протокола по клиническим исследованиям.
Заявку Вы можете подать по телефону 8 (499) 550-28-01 или по электронной почте podd-elena@yandex.ru.
9-20
Лечащие врачи:
Поддубская Елена ВладимировнаОнколог, хирург высшей категории. Кандидат медицинских наукПодробнее о враче
Слетина Светлана ЮрьевнаВрач онколог. Кандидат медицинских наукПодробнее о враче
Бондаренко Алексей ПавловичОнкологПодробнее о враче
Баранова Мадина ПетровнаОнколог, хирург-маммолог. Кандидат медицинских наукПодробнее о враче
Аббасова Дарья ВалерьевнаОнколог, маммолог. Кандидат медицинских наук.Подробнее о враче
Никитина Екатерина АндреевнаОнколог, маммолог. Кандидат медицинских наукПодробнее о враче
Первичный приемОнкологАкушер — гинекологМаммологКардиологМассажистПроктологФлебологХирургУЗИ
Как осуществляется процедура донации?
В норме каждый месяц у женщины вырабатывается одна яйцеклетка. Для донорства одной яйцеклетки недостаточно, так как по разным причинам она может не подойти для донации. Поэтому женщине-донору проводится медикаментозная стимуляция овуляции, вследствие чего созревают несколько яйцеклеток. Эта процедура безопасна для донора и проводится под полным контролем врача клиники.
Впервые Вы посещаете репродуктолога на 3-5 день менструального цикла. Врач проводит гинекологический осмотр, делает УЗИ органов малого таза и принимает решение о возможности Вашего участия в программе. Если все в порядке, Вам назначается дополнительное обследование (анализы, УЗИ, консультации специалистов). После успешного завершения обследования Вас заносят в базу данных, и Вы можете принять участие в процедуре донации (программа стимуляции суперовуляции) со следующего менструального цикла.
Во время программы стимуляции донору назначаются препараты, стимулирующие овуляцию. Врач отслеживает процесс созревания фолликулов. В определенное время назначается так называемый триггер овуляции – препарат, который позволяет контролировать момент выхода яйцеклетки из фолликула. Через 34-36 часов после этого проводится пункция (забор ооцитов). Это малоинвазивная процедура, которая проводится под общей анестезией и занимает порядка 15 минут. Затем Вы отдыхаете в отдельной палате в течение нескольких часов, получаете компенсацию и можете ехать домой.
Этапы проведения клинического исследования:
- Подписываем CDA (соглашение о неразглашении)
- Обсуждаем дизайн и сроки КИ
- Разрабатываем основной пакет документов на КИ
- Выбираем центры, проводим визит оценки, согласовываем центры со Спонсором
- Разрабатываем синопсис, расчет выборки, бюджет КИ
- Подписываем договор на проведение работ
- Осуществляем сбор и подачу досье в Минздрав РФ на РКИ, сопровождаем процесс получения РКИ
- Получаем разрешение Минздрава РФ на проведение исследования
- Получаем разрешение на ввоз образцов. Организуем ввоз ЛП (при необходимости)
- Готовим клинический центр к проведению КИ, подаем досье в ЛЭК, заключаем Договор с центром/ами
- Анализируем и обрабатываем данные, формируем итоговый отчет
- Осуществляем выгрузку базы данных
- Проводим Мониторинг и проверку переноса данных
- Проводим клиническую часть исследования
- Подаем документы, получаем экспертное заключение Минздрава РФ о проведенном КИ
- Сопровождаем процесс принятия отчета и отвечаем на запросы и замечания от экспертов Минздрава РФ
- Формируем итоговый пакет документов для регистрационного досье
Как проходят клинические исследования
— Если всё в порядке, тогда приглашают на госпитализацию, которая обычно длится 1,5 суток или чуть больше. За одно исследование их требуется две или четыре. Вечером заселение, рано утром подъем, прием препарата под наблюдением врача, сдача крови и сидение в коридоре в течение нескольких часов: по протоколу какое-то время нельзя принимать горизонтальное положение — ну и чтобы быть на виду у врачей. Потом можно расходиться по палатам и заниматься своими делами.
Сдавать кровь нужно в течение всего дня. В целом крови за всё исследование уходит примерно как при сдаче на донорство (450 миллилитров), иногда чуть больше, иногда чуть меньше. Время от времени врачи интересуются твоим самочувствием, измеряют давление. Несколько раз кормят. Контактировать с посторонними и получать от них посылки, а также проносить свою еду и курить запрещено.
Утром сдача крови и выписка, после чего нужно прийти в клинику еще через 24 и 48 часов для сдачи анализов (но количество визитов зависит от исследования). Затем следующая госпитализация, где всё повторяется. И так до конца, после чего получаешь деньги.
Какие бывают виды клинических исследований?
Особенности проведения клинических испытаний также зависят от типа исследований.
- Открытые исследования. При открытом исследовании, которое направлено только на изучение свойств препарата, без сравнения с другими уже известными лекарствами, и врач и пациенты осведомлены о том, какое лекарство проверяют;
- Сравнительные исследования. Этот тип исследования необходим для того, чтобы сравнить новый препарат с уже существующими методами лечения. Для этого всех участников делят на две группы: контрольная (получающая уже проверенное стандартное лекарственное средство) и тестовая (проходящая терапию новым препаратом;
- Слепые исследования. Слепые исследования — противоположность открытым. При простом слепом испытании только пациент не осведомлен, какое лечение он получает. При двойном слепом — это остается в тайне и от врача и от пациента. Таким образом стараются снизить риск подтасовки результатов теста из-за заинтересованности кого-то из участников исследования в получении определенных результатов;
- Плацебо-контролируемые исследования. Плацебо — препарат «пустышка», который получает часть пациентов, тогда как вторая часть принимает настоящее лекарство. Плацебо по виду и вкусу не отличаются от тестируемого препарата, чтобы участники не смогли догадаться, что проходят «ненастоящую» терапию. Такой метод позволяет оценить, какую роль в результатах теста занимает психологическая составляющая: внушаемость пациентов, внимательное отношение врача и сам факт лечения.
Порядок действий при очной консультации:
- Обратиться по адресу: г Москва ул. Каширское шоссе дом 23 (метро Каширская) Начуно-консультативное отделение (Поликлиника) НИИ Клинической Онкологии , регистратура №1 или Научно-консультативное отделение НИИ ДОГ.
- После первичной консультации больной осматривается ведущими сотрудниками профильного отделения, материалы рассматриваются консилиумом онкологов в составе хирурга, химиотерапевта и радиотерапевта, результаты которого оформляются документально в виде: консультативного заключения о принятом решении госпитализировать больного для лечения или рекомендации лечения в другом (по месту жительства) медицинской организации.
- Для ускорения сроков ожидания госпитализации необходимо иметь обязательный минимальный объем обследования для плановой госпитализации. С действующим сроком обследования.
- Общий анализ крови —10— 14 дней
- Общий анализ мочи —10— 14 дней
- Биохимический анализ крови (глюкоза, общий билирубин и его фракции, АСТ, АЛТ, мочевина, креатинин, щелочная фосфатаза, белок) — 10 —14 дней
- Коагулограмма — 10 — 14 дней
- Анализы крови на ВИЧ, маркеры гепатита В и С — 3 месяца
- Анализ крови на сифилис — 3 месяца
- Группа крови и резус фактор (учитывать наличие результата на бланке ЛПУ)
- Рентгенография органов грудной клетки или флюорография — 1 год
- ЭКГ — 1 месяц
- Консультация терапевта — 1 месяц
- Консультация для женщин – гинеколог, маммолог , (УЗИ молочных желез до 40 лет с 40 до 50 лет маммография 1-раз в 2-а года и с 50-и лет 1-раз в год)
При госпитализации необходимы следующие документы:
- Свидетельство о рождении или паспорт.
- Действующий полис ОМС или гарантийное письмо.
- Анализ крови на ВИЧ, RW, гепатиты В и С (срок действия 3 мес.)
- Листок нетрудоспособности (при наличии)
Наличие перечисленных медицинских документов обязательно для госпитализации.
В большинстве случаев в день очной амбулаторной консультации, при наличии показаний, будет определена дата планируемой госпитализации. Тем не менее, есть ряд высоко востребованных направлений, где существует очередь на плановую госпитализацию. В случае наличия очереди на госпитализацию, дата госпитализации будет сообщена дополнительно.
Обращаем Ваше внимание, что амбулаторные лабораторно-диагностические исследования не входящие в базовую программу ОМС предоставляются на платной основе или будут рекомендованы пройти по месту жительства.
Следует помнить!
- Консультация и госпитализация по ОМС возможна только в случае, когда пациент обследован в необходимом объеме, что должно быть подтверждено медицинским документами, и при отсутствии противопоказаний.
- Медицинский страховой полис должен быть действующим, прежде чем обратиться в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, необходимо обратиться в медицинскую страховую компанию, где застрахованы, и убедиться не погашен ли Ваш медицинский страховой полис:
- В случае, если меняли паспорт поменяли, а медицинский страховой полис нет, страховой полис недействителен.
- В случае, если Вы не имеете Российское гражданство, но имеете либо вид на жительство или временную регистрацию в России, необходимо менять медицинский страховой полис ежегодно.
Временный медицинский страховой полис действительный только 30-ть рабочих дней.
Можно также проверить по Интернету действующий ли Ваш медицинский страховой полис.
Контактная информация:
Фактический адрес: 115478, г. Москва, Каширское шоссе д.23
Справочная служба +7 (499) 324-24-24
Информацию по вопросам оказания медицинской помощи по ОМС можно получить также в следующих учреждениях:
Для обращения граждан по вопросам медицинского страхования, экспертизы медицинской помощи, порядка получения полиса и его замене работает телефон горячей линии ОМС: 8-800-100-81-22
Московский городской фонд обязательного медицинского страхования
Почтовый адрес: 117152 Москва, Загородное шоссе, д. 8а
Телефон: +7 (495) 958-18-96
Отдел организации защиты прав застрахованных: +7 (495) 952-93-21
Сайт: www.mgfoms.ru
Министерство здравоохранения Российской Федерации
Почтовый адрес: 127994 ГСП-4 Москва, Рахмановский переулок, д. 3
Телефон: +7 (495) 627-29-93
Телефон «горячей линии»: +7 (495) 627-24-00
Электронная почта: info@rosminzdrav.ru
Сайт: www.rosminzdrav.ru
Весомые аргументы
Преимущество такого рода испытаний — в относительной простоте их проведения. Необходимое количество участников в них на порядок ниже, чем в тех исследованиях, что проводятся сейчас. Разрешение на инфицирование добровольцев значительно повысит скорость разработки вакцины, предполагают ученые.
Также благодаря этому методу медики, вероятно, смогут ответить на вопросы о том, как развивается COVID-19. Например, выяснить, какое количество вируса должно попасть в организм, чтобы произошло заражение. Этот вопрос до сих пор остается открытым, так как без намеренного заражения найти на него ответ не получается.
Опыты на людях
 Фото: REUTERS/David Mercado
Фото: REUTERS/David Mercado
Еще один довод в пользу отмены запрета — возможность подобрать участников с хорошим здоровьем, риски тяжелого течения болезни для которых будут минимальны. При этом на весь период испытаний добровольцы будут находиться под непрерывным контролем врачей, что дополнительно снизит вероятность каких-либо осложнений.
В мае 2020 года Всемирная организация здравоохранения выпустила документ, в котором сказано, что испытания с намеренным заражением добровольцев будут полезны для борьбы с пандемией. При этом в ВОЗ осознают, что разрешение подобных экспериментов вызовет множество этических вопросов. Организация составила список универсальных критериев, которым должно соответствовать любое исследование с намеренным инфицированием. Они требуют, чтобы работу проводили по самым высоким медицинским и общественным стандартам, а потенциальная польза от исследования значительно превосходила риски.
Стать подопытным
Я вас предупреждал, что варианты будут крайне специфичными. Так вот, в силу того, что самую разнообразную косметику и даже лекарства необходимо проверять не только на бедных мышках, но и людях у вас всегда есть возможность обратиться к исследовательской группе и попроситься к ним волонтёром.
Разумеется, обо всех рисках вас ознакомят, да и вы сами будете понимать, что пошли не клубничку собирать, и возможно некоторые побочные эффекты окажутся весьма нестабильными и непредсказуемыми.
Зато, как правило, подобные исследователи платят весьма кругленькую сумму за ваш героизм, опять-таки, если вас не испугают различные предупреждения о возможных негативных проявлениях медикаментов и косметики.
Если вы менее рискованный человек, то статья о том, как можно заработать просто сидя в интернете, для вас.
Медицинские Эксперименты За Деньги Москва
- Научные исследования новейших препаратов – это не самоцель для фармацевтических компаний, а один из важнейших и обязательных этапов разработки с целью дальнейшей регистрации лекарственного препарата и его последующего применения в клинической практике.
- Клинические исследования проводятся строго с соблюдением всех этических норм и принципов, таких как добровольное участие, информированное согласие участника и не причинение вреда его здоровью. В информированном согласии детально сообщается о целях и методах исследования, информация об изучаемом препарате и курсе лечения, а также о возможном риске. Таким образом, главным приоритетом в первую очередь является защита интересов пациента.
- Любое клиническое исследование выполняется согласно тщательно разработанному плану, одобренному и прошедшему проверку у независимых экспертов. Для одобрения плана результаты экспертизы должны показать, что потенциальный риск для участников исследования сводится к максимально низкому уровню. Участникам гарантируется полное соблюдение конфиденциальности.
- Гарантия защиты безопасности участников предусматривается специальными государственными протоколами, регулирующими клинический процесс исследования. На основе поступающих новых данных об изучаемом препарате исследование сразу прекращается, если наблюдается изменение в соотношении пользы и риска для здоровья.
Клинические исследования являются неотъемлемой частью современной медицины, ведь развитие лекарственных препаратов невозможно без проведения исследований. Под клиническим исследованием понимают процедуру научного исследования уровня безопасности, а также эффективности лекарственного средства. Клинические исследования, как правило, проводятся, при участии людей. Благодаря исследованиям, можно получить достоверную информацию о эффективности препарата, побочных эффектах, уровне безопасности для жизни. Следует отметить, что новое лекарственное средство просто не может быть зарегистрировано, если оно не прошло клиническое исследование. А отсутствие регистрации – это запрет на продажу медицинского препарата на рынке. Кроме того, основанием для отказа в регистрации могут служить негативные результаты клинических исследований. Однако это не значит, что клинические исследования были проведены напрасно, вовсе нет, ведь даже отрицательные результаты дают возможность ученым развиваться вперед, находить безопасные способы лечения.
Заключение
Таким образом, нормативно-правовое регулирование обеспечения прав пациентов во время проведения клинических исследований в российском законодательстве в целом соответствует международным нормам, хотя отдельные его аспекты все же могут быть усовершенствованы.
В частности действующее законодательство не выделяет договора, заключаемые с участниками клинических исследований, в отдельную категорию. Интерпретация различных актов, содержащих отсылки к таким договорам, позволяет трактовать их как договора возмездного оказания услуг либо трудовые договора. При этом, законодательство не предусматривает льгот по оплате налогов и страховых взносов для выплат по указанным договорам. Зачастую платежи участникам клинических исследований носят компенсаторный характер в связи с теми расходами, которые пациенты вынуждены нести. В связи с этим, нам представляется необходимым устранить коллизии нормативных актов и актуализировать налоговое законодательство, в том числе в части предоставления налоговых вычетов участникам клинических исследований.
Закрепляя обязанность получения информированного согласия пациента, федеральные законы не дают единого и системного представления о перечне информации, с которой участнику клинического исследования надлежит ознакомиться. Видится необходимым скорректировать № 61-ФЗ, устранить дублирование различных пунктов и размытые формулировки, сформулировать основные категории, которые должны быть отражены в информированном согласии, соотнести их с международными нормами (в том числе с Хельсинской декларацией).
Отдельного внимания требует вопрос реализации прав недееспособных пациентов их законными представителями. В частности, необходимо более подробно разработать механизмы включении в клинические испытания людей с ограниченными возможностями и получения их согласия (когда потенциальные участники лишены не воли, а возможности письменного волеизъявления). Например, такие механизмы могли бы предусматривать привлечение нотариусов к фиксации юридического факта получения информированного согласия пациента на участие в клинических исследованиях.
Минимизации рисков, связанных с участием граждан в медицинских испытаниях, способствует также институт обязательного страхования, предусмотренный в Федеральном Законе «Об обращении лекарственных средств». Несмотря на достаточно детальную регламентацию порядка страхования и осуществления выплат, установить причинно-следственную связь между участием в клинических исследованиях и наступлением вреда зачастую можно только с помощью экспертизы. Имеется как положительная, так и отрицательная практика по данной категории дел, при этом решения судов преимущественно основываются на данных экспертиз. Прогнозировать судебную перспективу по таким делам затруднительно в связи с ограниченным доступом пациентов и выгодоприобретателей к результатам исследований и рандомизации даже после их окончания.
Особое внимание законодателя уделено защите уязвимых групп населения при проведении клинических исследований. В современном законодательстве основные группы в достаточной мере защищены, однако, международное законодательство устанавливает более строгие стандарты
Представляется также, что организаторы международных исследований должны ориентироваться на них с обязательной поправкой на уровень жизни в России лиц, ограниченных в доходах. Вместе с тем, в определенных случаях, сотрудники государственных предприятий и организаций в России находятся в более уязвимом и зависимом положении, чем, например, национальные меньшинства, что ставит вопрос о возможностях их защиты в случае избыточно настойчивого вовлечения в участие в испытаниях.
Следует отметить, что добровольное информированное участие испытуемых в клинических исследованиях обеспечивается на практике, в том числе, и через деятельность контролирующих органов при выдаче соответствующих разрешений. Тем не менее, на наш взгляд, на сегодняшний день существуют возможности для дальнейшего совершенствования норм законодательства, посвященного обеспечению прав пациентов во время клинических исследований.